De aanleiding
Ik kwam op Facebook in een discussie terecht over een oude bekende, het mineraal olivijn als middel om CO2 uit de lucht te halen. Af en toe laait die discussie weer op, de laatste keer vanwege een artikel in de NRC dat “zeven km3 olivijn genoeg is om de aarde te redden”. Zie Zeven kubieke kilometer olivijn om de aarde te redden .
De discussie gaat terug op prof. Olaf Schuiling. Kennislink wijdt een pagina aan hem ( www.nemokennislink.nl/publicaties/peridotieten-zijn-gek-op-co2/ ). Daar blijkt overigens dat die “zeven km3 “ “zeven km3per jaar” moet zijn en dat de redding van de wereld neerkomt op het compenseren van alle verbranding van fossiele brandstoffen.


(afbeelding links By Rob Lavinsky, iRocks.com – CC-BY-SA-3.0, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=10448817 )
Wat is olivijn en hoe gedraagt het zich?
Olivijn is een dieptegesteente. Het kristal is stabiel op zo’n 400km diepte en wordt alleen aan het aardoppervlakte gevonden als er diepe lava aan de oppervlakte uitgestroomd is. Dat gebeurt soms. Het materiaal dankt zijn naam aan de kleur en kan in extreme gevallen edelsteenkwaliteit bereiken.
De chemische samenstelling is XYSiO4 . Daarbij kunnen X en Y staan voor magnesium (Mg), tweewaardig ijzer (Fe) , en voor sporenelementen waarvan het giftige nikkel (Ni) de belangrijkste is. Als zowel X als Y magnesium is, heet het mineraal Forsteriet.
Meestal zit Olivijn in een menggesteente waarin bijvoorbeeld ook witte asbest kan voorkomen.
Het kristal is aan de oppervlakte niet meer stabiel en verweert daarom. Het kan ook gewoon van nature CO2 binden, alleen gebeurt dat uiterst onpraktisch langzaam als het materiaal gewoon een bonk is.
De verweringsreactie is voor forsteriet (in een waterig milieu)
2H2O + 4CO2 + Mg2SiO4 –> 2Mg2+ + SiO2 + 4HCO3–
SiO2 is gewoon kwartszand en het HCO3– -ion (ook wel het bicarbonaation) is wat je ook krijgt als je bakpoeder of zuiveringszout in water gooit.
De reactie is dus niet exotisch.
Voor het verweren van olivijn moet er water en CO2 kunnen toetreden. En omdat zich een korstje kan afzetten, is het handig als het materiaal in beweging blijft.
Toetreding gaat makkelijker bij een groot oppervlak, en dus een kleine korrel.
Wil je dus iets met olivijn, dan moet je het mijnen, transporteren, en heel fijn malen en verspreiden. Dat kost energie en als regel CO2 en dat moet je in mindering brengen op de opbrengst. Je moet dus een Life Cycle Assessment maken (LCA).
Recente research en praktijk
Het artikel in de NRC (in de geo-engineeringbijlage van 20 juni 2020) baseerde zich op een onlangs gestarte praktijkproef van Deltares, een gerenommeerd kennisinstituut. Wat Deltares erover kwijt wil, is te vinden op www.deltares.nl/nl/projecten/olivijn-validatie-rekenmodel-met-veldproef-op-campus-van-deltares/ .
Rijkswaterstaat RWS) heeft in 2012 zo’n LCA gemaakt (onderstaande illustraties zijn uit die publicatiue afkoomstig). De verwijzing is http://publications.deltares.nl/1203661_000.pdf en die is te vinden op bovenstaande Deltares-pagina. Daar staat ook een praktijkproef in Rotterdam. De zoekterm rws olivijn geeft nog wel meer resultaat.
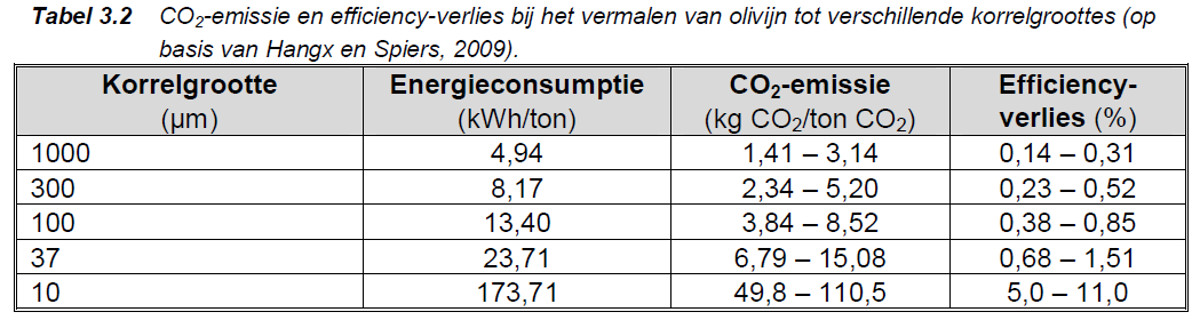
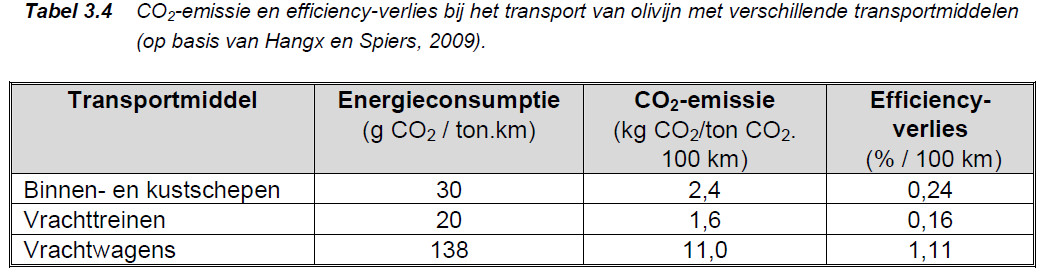
Zuivere forsteriet kan per 1 kg forsteriet 1.25 kg CO2 binden. Na diverse aftrekposten blijft ongeveer 1 kg CO2 per 1 kg forsteriet over.

Daarnaast heeft RWs gebruik in de landbouw geanalyseerd.
Het analyseresultaat beschrijft hoe snel het olivijn voor 80 en 100% wegverweerd is. Dat is vooral afhankelijk van
- de korrelgrootte (kleinere korrel, snellere verwering)
- de omgevingstemperatuur (warmer is sneller, tropen werken beter dan gematigde breedtes)
- hoe zuur het water is (hoe zuurder, hoe sneller). Omdat landbouwgrondwater zuurder is, gaat het in de landbouw sneller.
Al met al praat men in de landbouw over jaren tot decennia en in de kustlijn over decennia tot enkele eeuwen.
Voor- en nadelen
Het nut van olivijn is in meerdere opzichten dubbelzinnig.
Het is juist dat olivijn primair CO2 uit de lucht bindt .
Maar de stof doet dat in water en daarbij ontstaat het HCO3– -ion . Dat kan op verschillende manieren doorreageren.
Het eindmengsel kan neerslaan tot het onoplosbare MgCO3 ,bijvoorbeeld als het water opdroogt. Dan komt de helft van de gevangen CO2 alsnog in de lucht, maar de andere helft zakt naar de bodem of wordt een witte aanslag.
Het HCO3– -ion kan ook reageren met zuurionen ( H+). Per H+ ion komt er dan weer een CO2– molekuul in de lucht (dat is precies wat zuiveringszout doet met brandend maagzuur – leve de Rennie). Maar het H+ ion kan ook uit zure regen of uit stikstofdepositie komen. En het H+– ion kan ook in de verzuurde oceaan zitten, die door het HCO3– -ion een beetje minder zuur wordt.
Het kan ook zijn dat een HCO3– -ion een mossel tegenkomt en zich aanbiedt om een schelp mee te bouwen.
Men kan dus niet met alleen de primaire reactie volstaan en moet ook een theorie opbouwen over het vervolg.
Je kan olivijn op goede gronden dus zien als een klimaatoplossing die soms zuur bindt, maar ook als een zuurbinder die soms het klimaat helpt. Die twee sluiten elkaar uit.
In principe kan men olivijn zien als een stof die kalk vervangt bij het ontzuren van landbouw- of bosbodems (want uit kalk komt bij het zuurbinden CO2 vrij) . Bij olivijn ook, maar die CO2 had je eerst gevangen.
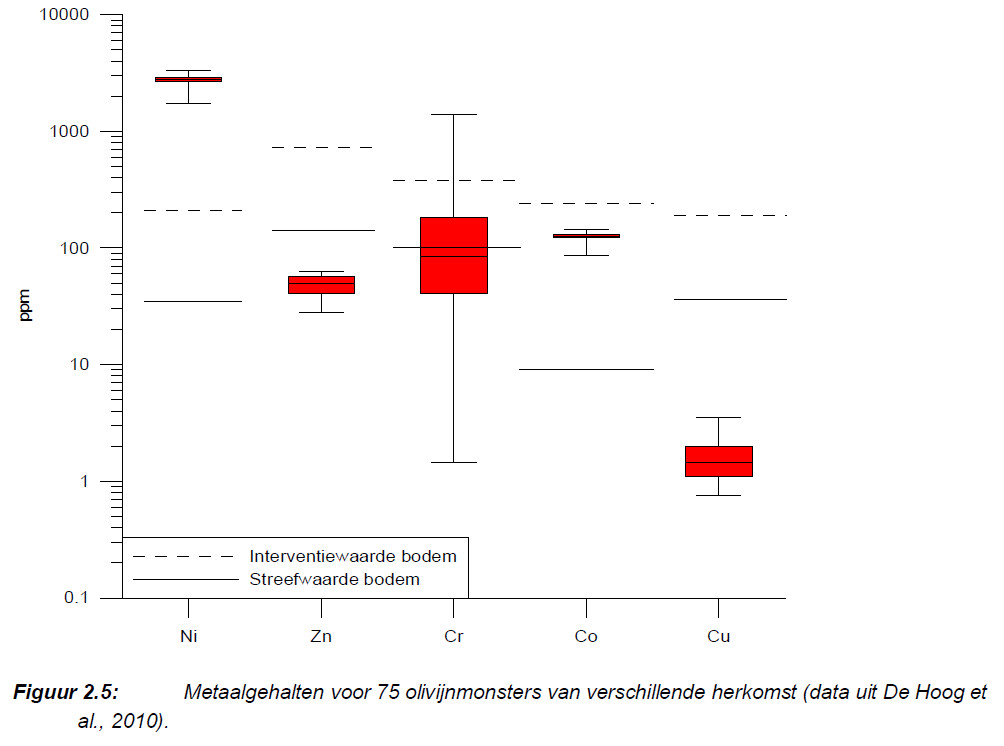
Bijkomend voordeel is dat uit olivijn magnesiumionen vrijkomen, die planten graag opnemen voor de opbouw van chlorophyll. Het is overwogen om olivijn als meststof in te zetten, maar het probleem is vooral de nikkelbijmenging. Die ligt ver boven de interventiewaarde van vervuilde bodems. Nikkelloze olivijn zou een interessante grondstof zijn.
Olivijn is een interessante stof, maar geen wondermiddel. Men moet niet alleen de primaire reactie analyseren, maar ook het natraject.